AAV基因疗法在罕见病和遗传病等领域的可行性和有效性为其赢得了全球越来越多的关注,加入赛道竞争的玩家也不断增长,仅近一个月内就公开了多个里程碑消息。国际上进展Zui快的候选产品当数CSL Behring的etranacogene dezaparvovec(EtranaDez),于2022年3月28日宣布其上市申请已获得EMA的受理,若获批,该候选产品将成为B型血友病患者的首个AAV基因疗法选择。
随着许多研发企业涌现,展现比肩国际的创新潜力,国内AAV基因疗法的讨论度同样愈发火热。到目前为止已有30余项AAV基因疗法的临床试验申请(IND),涵盖纽福斯、信念医药、嘉因生物、锦篮基因、至善唯新、华毅乐健、天泽云泰等多家企业。
随赛道趋势发展,AAV基因治疗赛道上迈过IND门槛的候选产品将越来越多,国内AAV疗法业内关注的焦点也因此有所改变。不管是监管机构还是研发企业,其动向均显示,GMP级生产已成为AAV基因疗法产品竞争力的要素之一。
一、工艺vs需求:GMP级转染试剂聚焦多重优化关键
(1)监管动向:可放大的GMP需求快速增长
2022年3月,Selecta Biosciences公司宣布,美国FDA于3月9日解除对其临床试验的控制,继续推进AAV基因疗法SEL-302治疗甲基丙二酸血症的项目。此前,由于缺乏与候选药物相关的化学、生产工艺和控制方面的数据,FDA对该公司的基因治疗候选药物SEL-302的II/III期试验发出了一封搁置信。
另外,值得注意的是,2021年6月, “中国药品监管科学行动计划”的第二批zhong点项目将基因治疗产品评价体系及方法研究位列第二,2022年后续发布的《基因治疗产品非临床研究与评价技术指导原则(试行)》、《基因治疗产品长期随访临床研究技术指导原则(征求意见稿)》更完善地覆盖了基因治疗的研发阶段、临床前研究到临床试验后随访和上市后随访阶段。可见,监管机构对于工艺优化、质量控制等GMP级生产要素的具体验证数据的需求并不只存在于Zui终申报上市的阶段。
因此,未来的趋势将需要CMC更早地进入药物研发、临床试验和商业化工艺优化的流程中,以助力AAV基因疗法的顺利转化。
(2)转染试剂:聚集工艺提升、试剂材料和供应链的多方优化需求
在这样的监管环境下,AAV基因疗法产品研发存在着快速增长的GMP级生产需求,例如GMP级的PEI转染试剂已经成为众多治疗载体开发和临床转化的要素之一。然而,现有的常见工艺和体系面对工业化生产的需求时,在工艺提升、试剂材料选择和供应链的建立等多个环节中,均依然存在不可忽视的痛点。例如,规模化shun时转染中转染的效率和质量是保证高产量和可靠的AAV病毒载体商业化制造过程的关键。
曼博生物作为美国polysciences品牌官方授权的中国区Du家经销商,在提供优质的进口cGMP级PEI转染试剂MAXgene GMP同时,曼博生物凭借自身实力,为国内赛道提供稳定运输条件和gao效供应能力,以此建立了MAXgene GMP成熟的本土化应用流程,共同加速国内AAV基因治疗方案的开发转化之路。

(3)转染环节折射的痛点需求
1、工艺提升
首先,在商业化生产工艺流程的开发过程中,规模化shun时转染是AAV生产共同选择的转染方式,上下游中均存在一些制备工艺和制备方法,它们虽已是目前AAV制备Zui常见的技术,但是可扩展性有限。例如,相对传统实验室生产工艺(使用贴壁细胞)而言,无血清悬浮培养不仅更具可拓展性,还减轻了下游纯化的负担;另外,常见的亲和层析法虽然在规模上可以大量分离AAV衣壳,但无法区分空衣壳,且不同血清型所需填料的特异性较高,成本随之增长。
同时,在生产中,转染试剂的性质、供给和转染效率也需要维持稳定状态,才能保证细胞质量,降低成本损耗。这一工艺需求考验着转染试剂的供给稳定性。例如,曼博生物在国内的备货仓库分布已超过5个城市,其稳定的供应能力使其在类似疫情的受限时期也能够针对进口产品的特殊性维持有力的产品提供,稳健地满足AAV的生产需求,为客户显zhu降低使用高品质进口试剂的供应风险。
2、试剂质控
如果早期药物研发过程中认为遵循GMP级生产不是必需,那么从实验室方案过渡到放大规模的商业化方案的过程就需要适应细胞、更改其他原料、适应不同工艺流程要点等操作。一方面,其时间成本可能需要几个月且存在失败的概率;另一方面,替代原料的选择还须通过可靠分析方法的验证,以保持产品前后质量的一致性。因此,尽早选择GMP级原料或者可放大的系列产品是助力生产工艺向规模生产转化的优势选择。
二、MAXgene GMP优势
MAXgene GMP作为美国Polysciences公司开发的一款cGMP级PEI转染试剂,可用于细胞和基因治疗病毒载体的开发和生产,是用于临床等级AAVs,LVs和重组蛋白生产的理想试剂。作为一款quan合成、无动物源成分的更高性价比GMP级转染试剂,目前,国内外已有多个使用该产品的项目进入临床阶段。

▲ Maxgene GMP应用示意图
其优势包括:
1、可扩展性,适用于临床和商业化生产:
MAXgene GMP是在Polysciences的研究等级转染试剂(PEI MAX 或 Transporter 5)的效率和可扩展性基础上增加了验证工艺和监管流程,使其可满足临床和商业化用途的监管合规需求。
这也意味着,通过MAXgene GMP,Transporter 5和PEI MAX,Polysciences提供了一系列完整的产品方案(固体粉末和液体形式),可覆盖研究和生产工艺及商业化的全部阶段,并且易于规模放大和质量等级升高过程时的质量验证,保持产品的稳定性。
生物工艺生产放大顺序

▲ Polysciences的PEI试剂可覆盖全流程的工艺放大
2、质量控制更优,可带来更高转染效率:
Polysciences严格的配方、制造和质量控制流程可保证各批产品都符合既定的特性、效价、纯度、可追溯性和安全性规范。
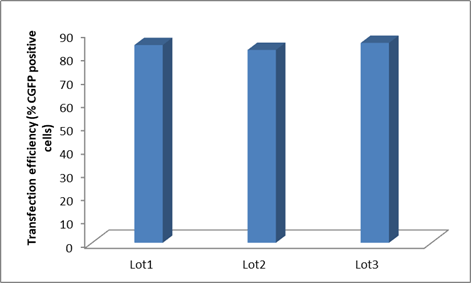
▲ Polysciences PEI的优秀稳定性
3、资质认证,助力多元化市场开发:
除批次稳定外,该cGMP解决方案已通过ISO 13485质量管理体系的认证,满足FDA和NMPA等多重监管体系的合规要求,使AAV产品在生产质量验证上具备更广阔的可比性,对于需求中美双报等竞争视角全球化的候选药物,MAXgene GMP可适用更多元的市场。
4、跨国供应链建立,满足本土化生产需求:
曼博生物能够提供一条适应常态风险的更高效的供应链,使客户能够稳定及时地获得Zui实时的产品状态跟踪,跨国运输链中各环节反应迅速,为客户提供可预期的优质服务。
三、小结
AAV基因疗法的真正黄金时期似乎还未真正到来,赛道内各家候选产品的研发与工业生产还有着十足的优化空间。随着市场对质量控制的概念越来越重视,作为生产流程中上下游衔接的关键步骤,可放大的GMP级转染必然是未来AAV基因治疗行业的关注点之一。更优质的原料产品、更低的物流时间成本和更稳定的供应能力将是AAV生产加速的关jian影响因素。